Como profesionales de la salud, hace años que ventilamos a nuestros pacientes y, aun así, hay todavía cosas que no entendemos por completo o que nunca nos habíamos planteado, principalmente porque nadie nos lo enseña. Sabemos que nuestros pacientes necesitan algún soporte mecánico, para lo cual usamos gases a distintos flujos o generamos presiones con ellos, además, sabemos que esos gases, a la concentración adecuada, pueden corregir la hipoxemia o llegar a empeorar la hipercapnia. Pero la pregunta aquí es ¿los podemos usar tal y como nos salen de pared o de las balas?
Ya os adelanto que, hasta donde yo sé… no, la respuesta es no (no debemos). Me llamo Jorge y tengo la suerte de dedicarme a lo que me gusta, tratando de llenar este hueco de la práctica clínica general a través de mi actual puesto como especialista de producto en Fisher & Paykel Healthcare desde 2021, donde tengo el placer de actuar como asesor clínico externo para mis clientes y, antes de eso, he sido enfermero (tanto diplomado como graduado) durante los primeros 18 años de mi vida profesional, en los que he trabajado en la mayoría de ámbitos de la Atención Hospitalaria y Primaria, si bien me especialicé en Cuidados Críticos (UCI) tanto en la población adulta como la pediátrica. Trabajé en Valencia (España) la mayor parte de mi carrera, donde también inicié mi línea docente como profesor asociado en la Universidad de Valencia y formador EIR a nivel privado. Maduré aún más en Birmingham y Londres (Reino Unido) los seis últimos años en UCI pediátricas antes de fichar por la industria de dispositivo médico para ayudar a mejorar la asistencia clínica.
Hoy comparto este conocimiento gracias al espacio que me cede Isidro, de lírico apellido y viejo conocido de la docencia y la UCI. Me comprometo a ser claro, pero no podré ser breve, ya que he de condensar el trabajo de muchos profesionales, que yo no he descubierto esto…
Hablemos de humidificación de la vía aérea.
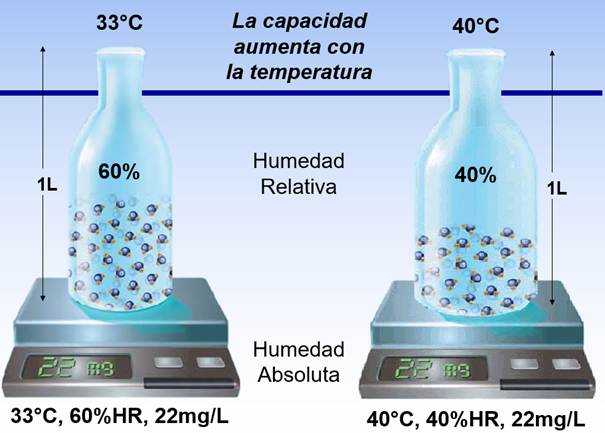
Empecemos con los básicos de física. Cuando inspiramos, lo hacemos en las condiciones en que se encuentra el gas a nuestro alrededor, en este caso el ambiente, es decir, a una temperatura y un nivel de Humedad Relativa cualesquiera a la presión atmosférica que nos encontremos. ¿Qué es eso de la Humedad Relativa (HR a partir de ahora)? Es el porcentaje de vapor de agua que “le cabe” a un gas a una temperatura concreta, es decir: del 100% que podría soportar en peso sin que se convierta en agua líquida ¿de cuánto estamos hablando?
Si has pillado este concepto meteorológico, lo interesante aquí es la Temperatura como añadido a la ecuación. Se sabe que cuanto más caliente está un gas, más vapor de agua puede contener. Ejemplo:
La misma Humedad Absoluta o HA (cantidad de vapor de agua, en peso) representa un porcentaje menor de HR cuando más caliente esté el gas. Un gas completamente saturado de vapor de agua se encuentra en su Punto de Condensación (límite de saturación isotérmica o “punto de rocío”) cuando, al bajar mínimamente la temperatura, se produce el fenómeno de condensación, es decir, vemos el agua en estado líquido. ¿Qué me estás contando Jorge? yo venía a aprender de cómo cuidar la vía aérea y tú me vienes con experimentos sobre el clima. Perdón, perdón. Sigo.
Vale, resulta que cuando inhalamos gases fríos y secos, se nos irrita la mucosa de la vía aérea y nos entra la típica tos seca, lo cual tratamos de evitar protegiendo boca y nariz con una bufanda. También sabemos que el aire acondicionado funciona sacando el agua del ambiente y, a la mayoría, eso les “seca la garganta”. Incluso dominamos el concepto de que, si respiramos por la nariz, nos molesta menos que por la boca. Todo muy básico, Jorge, dale brío.
1 Dawson et al. J Paediatr Child Health 50, 24–6 (2014) 2 Williams et al. Crit Care Med 24, 1920–9 (1996).
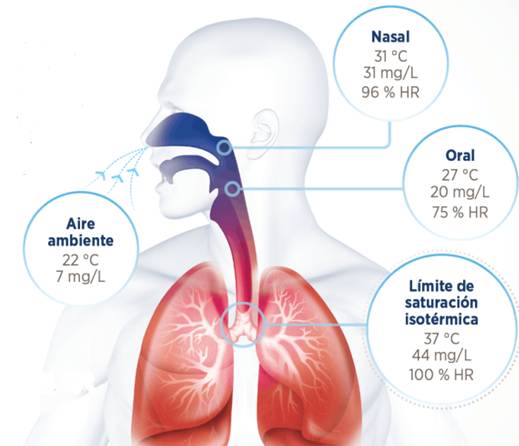
Bueno, pues pasa que, conforme inhalamos el gas no es como llega a nuestros alveolos. Hay todo un proceso de calentamiento y cesión de humedad por parte de la mucosa que recubre nuestra vía aérea. A esta mucosa se le conoce como Sistema de Transporte Mucociliar y, aunque luego volveremos a él, sabemos que, entre otras cosas, tiene el cometido de acondicionar el gas que respiramos para que, al margen de cómo éste nos “entrara”, llegue “a puerto”, para el intercambio gaseoso, en condiciones BTPS, eso es, en inglés, siglas para Temperatura Corporal (37°C), Saturado (100% HR = 44mg/L) y a la Presión atmosférica que nos encontremos. Ahora bien, resulta que esto tiene un coste metabólico, es decir, nosotros gastamos energía en ceder calor (15%) y humedad (85%) para que el gas nos llegue bien y, principalmente, este fenómeno sucede en la vía aérea superior. Concretamente, sabemos que el 95% de la humidificación sucede en nasofaringe y tráquea. Esto no es negociable, es fisiología.
Pues tampoco me has descubierto América, chaval, si naturalmente hacemos eso que dicen los estudios ¿para qué molestarnos en más? Yo, sujeto sano, pago el precio metabólico de consumo de energía y listo, pero ¿qué pasa con nuestro paciente cuya reserva energética está justita? Por eso ha venido al hospital ¿no? Se está esforzando ya bastante en conseguir meter aire en sus pulmones y que el O2 le llegue a la sangre. Y nosotros vamos y le damos gases fríos y completamente secos. ¿Qué pasa con ese paciente al que le hemos “bypaseado” la vía superior intubándole hasta carina? ¿Qué sucede con el paciente que ya de por sí tiene una traqueostomía? ¿Y aquel que por su patología crónica tiene ya la mucosa disfuncional?…
No hay ninguna conspiración de las gasistas aquí. El gas se almacena así porque es la forma eficiente de hacerlo y, aunque puede no salir demasiado frío, el problema es que, al administrarlo seco, lesionamos el Sistema de Transporte Mucociliar. Resulta que esto lo sabemos desde hace décadas, por eso se han hecho pinitos con inventos varios que aportasen al menos algo de humedad, como los sistemas de burbujeo frío o los HME (luego os cuento)…
Ya hemos averiguado que las condiciones óptimas del gas son 37°C y 44mg/L de HA (o 100% de HR), según 2Williams et al (1996) y que, según 3Ryan et al (2002), en esos parámetros adecuados, el gas es termodinámicamente neutro para las vías respiratorias (éstas no tienen que gastar energía), por lo tanto, óptimo para la ventilación. Así pues, ¿qué hacemos al respecto? ¿Cómo acondicionamos nuestros gases si es que lo hacemos? ¿Qué podemos cambiar en nuestra práctica clínica o la de nuestras unidades? ¿Lo estoy haciendo mal? Calma, respiremos…
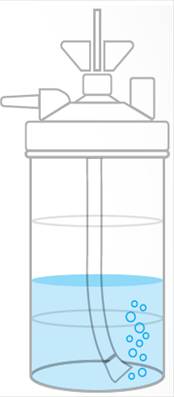
El mecanismo más sencillo y barato que a alguien se le ocurrió fueron los humidificadores fríos de burbujas, que es posible que todos hayamos usado alguna vez para administras oxigenoterapia convencional.
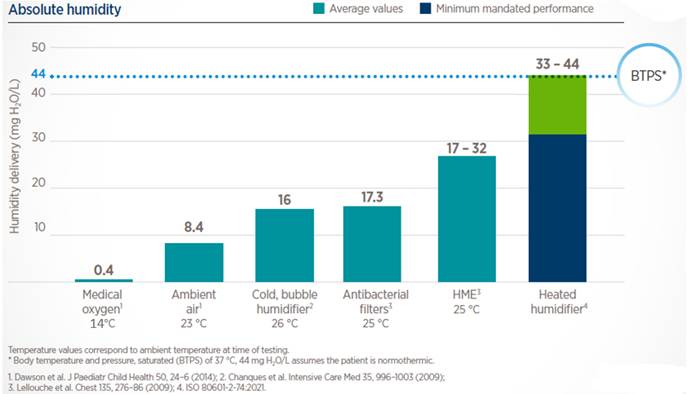
Pues eso, que es frío y, si el gas no se calienta, la humedad que somos capaces de entregar es muy limitada, en concreto, <50% HR a temperatura central según 4Darin et al (1982). De hecho, 5Franchini et al (2016) demostraron que, a nivel de mucosa, la humedad absoluta era prácticamente la misma a usar el O2 sin nada y que se produjo una reducción en el transporte mucociliar de los pacientes (enseguida comento lo que esto significa).
Pero aún hay más, una piscina de agua estancada, en un hospital, es un spa para bacterias; echad un ojo a 6Rhame et al (1986). Se trata de una práctica que suele estar en desuso (aunque lo sigáis viendo por ahí) y aún más desde la pandemia.
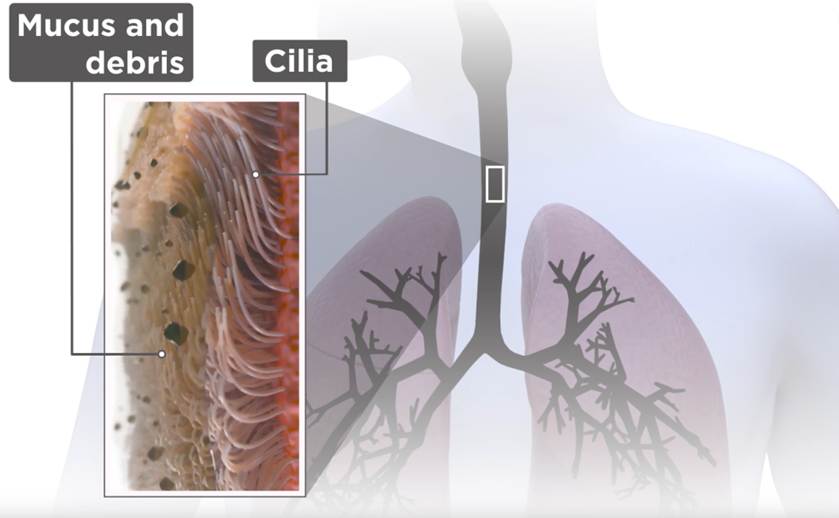
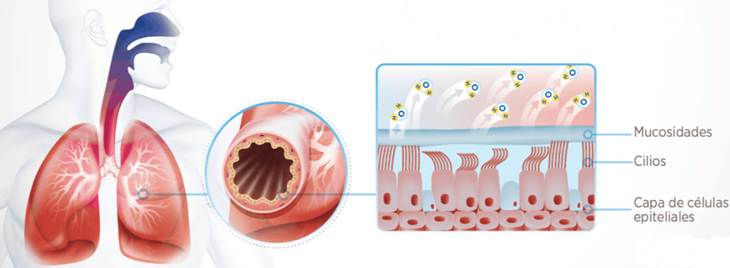
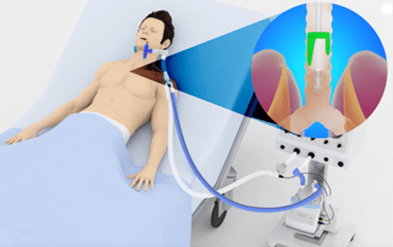
Pauso aquí para describir el Sistema de Transporte Mucociliar (STM en adelante), que te avisé de que lo haría. El dibujo de arriba es representativo de la parte expuesta de nuestro epitelio respiratorio: células ciliadas cuyos cilios se mueven en una solución acuosa con una cadencia perfecta y rapidísima, de forma que las puntas de los mismos puedan desplazar la capa mucosa que tienen por encima, formada por el moco (que producen nuestras células caliciformes) y los residuos que en ella quedan adheridos (patógenos, polvo, polen… esas cosas).
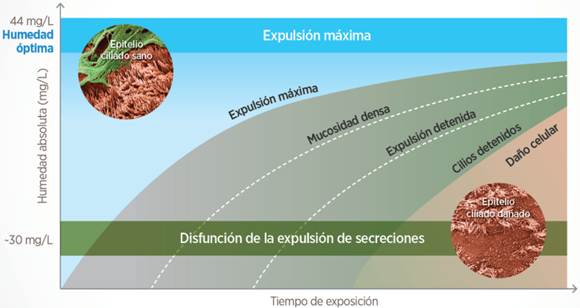
Si funciona bien, los cilios desplazan el moco hacia arriba hasta que activa nuestro gatillo del estornudo/tos y… para fuera. Ahora bien, si la solución acuosa cede demasiada humedad para acondicionar el gas que entra, desciende el grosor de esta capa y los cilios se quedan inertes, sin poder “bailar” para desplazar las secreciones, que ahora serán aún más espesas y viscosas (misma mucina, menos agua). Resumen: si algo funciona mal en el STM, la gestión de las secreciones se ve perjudicada y, si se lesiona en exceso la mucosa (como por exposición a gases secos) perjudicamos a células cuyo trabajo nos es de gran interés en ventilación mecánica.
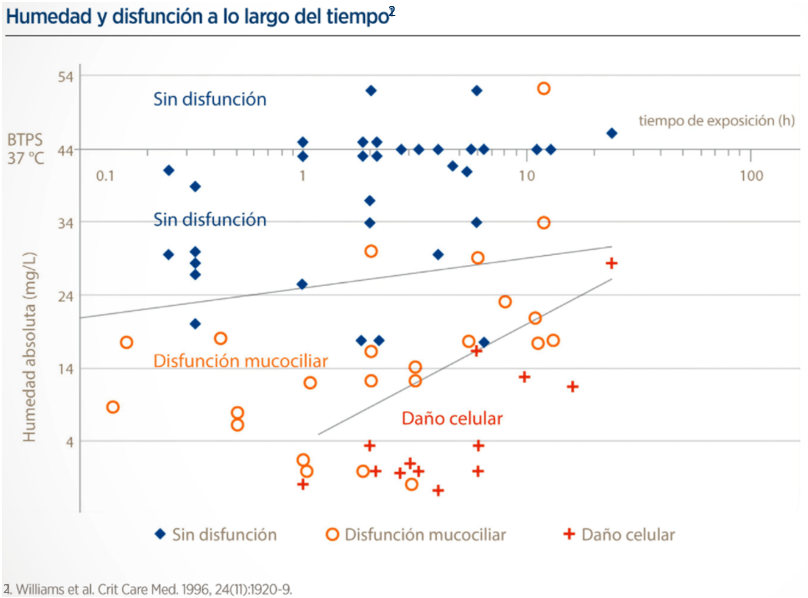
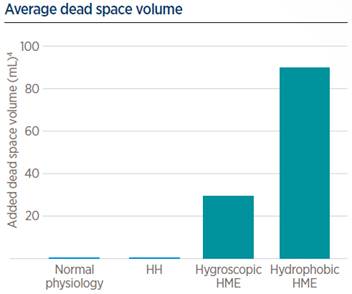
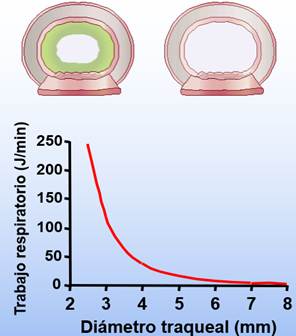
Como se ve en la figura de arriba (cada símbolo es un caso representativo tenido en cuenta en esa revisión sistemática), cuanto más tiempo esté expuesta la mucosa a humedad más baja, mayor es el grado de disfunción/lesión. De hecho, la previsión, pasadas 12h, con HA <30mg/L es bastante clara en este estudio sobre lo que le pasa al STM. Lo cual hace plantearse ¿qué pasa con el paciente intubado? ¿a partir de cuántas horas/días de intubación consideramos humidificación activa en nuestras unidades?
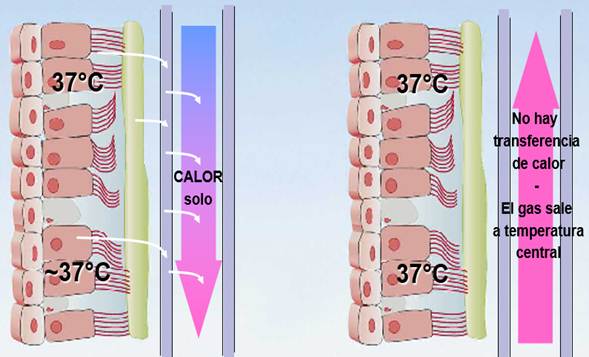
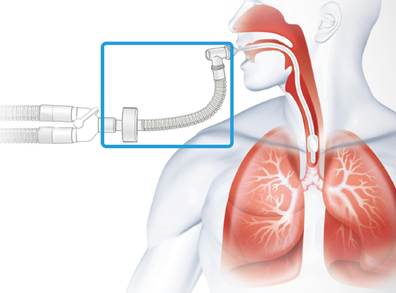
Mientras hay un tubo, en inspiración, algo de calor puede cederse al gas, pero nada de vapor de agua atraviesa el material del tubo endotraqueal (TET). Sin embargo, en espiración, mientras la mucosa recuperaba algo de calor y humedad antes (15% máx.), con el TET nada de eso es posible ahora (mayores pérdidas insensibles).
Como ya sabemos algo de esto (desde los ’70), la gente de críticos entiende que en seco no se puede ventilar y algo debe hacerse al respecto, por lo que optan aquí por dos alternativas, siendo la siguiente la que está más en desuso, el HME. Veamos por qué.
Conocido por sus siglas en inglés, el HME (Heat and Moisture Exchanger) o Intercambiador de Calor y Humedad recibe otros nombres. Lo habréis llamado humidificador pasivo, nariz artificial e incluso, algo desafortunadamente, filtro, ya que no todos lo son. Seguramente lo hayáis visto conectado a un tubo corrugado y/o un codo previo al TET. Voy a tratar de explicar cómo funciona y por qué nos genera problemas que no sabíamos.
En fase inspiratoria, el gas viene del respirador (frío y seco hemos acordado), atraviesa el HME y llega a los alveolos a través del TET haciéndole a la mucosa lo que hemos aprendido cuando la humedad es baja. En fase espiratoria, el STM de nuestro paciente ha cedido mucha temperatura y vapor de agua, pero parte de ellos se quedan ahora atrapados en el material higroscópico y/o hidrofóbico del HME. En la siguiente fase inspiratoria, al enviar el gas seco y frío, éste atraviesa las condiciones dejadas por la fase respiratoria anterior, cediendo algo al gas que ahora llega algo menos seco y frío. Como no aporta nada de humedad, sino que conserva parte de lo que produce el paciente, se le conoce como humidificador pasivo como decía antes.
Lo que hay que aclarar aquí, con todo lo que hemos visto hasta ahora, es: que con los HME el paciente siempre tiene una pérdida neta de energía (en forma de calor y humedad) y que la HA real no es suficiente (debería ser >30mg/L) y acaba produciendo disfunción y, finalmente, lesión del STM en base al tiempo de exposición (figura de abajo, basada en el mencionado estudio de 2Williams et al (1996)).
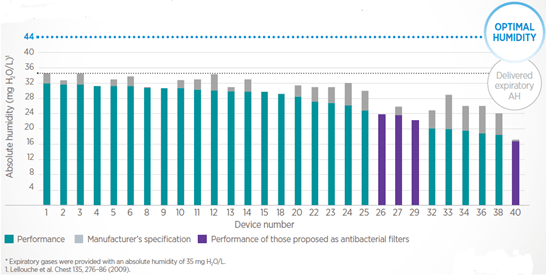
A todo esto, hay que añadir que: los HME que vienen con filtro (la mayoría de los que usaréis en vuestros centros de trabajo desde la pandemia) alcanzan aún menos HA según pruebas previas que mostraron un rendimiento menor al publicitado en los modelos antiguos (7Lellouche et al, 2009); que los HME se saturan de agua y obstruyen, por lo que hay que cambiarlos con regularidad (¿cada cuántas horas dice tu protocolo si es que no se ha llenado antes de esputo?); y que el paciente ha de respirar a través de ellos (luego veremos por qué es importante esta aclaración). Lo de los filtros, su eficacia y ubicación, y los cambios rutinarios de piezas del circuito requeriría de un post aparte, la verdad.
De todas formas, mi recomendación es que no os quedéis solo con esto ya que, algunos de vosotros estaréis pensando “pues siempre hemos usado HME en mi unidad y nadie ha tenido problemas”. Desarrollemos los problemas que se han asociado a su uso y las posibles contraindicaciones que conlleva (referencias bibliográficas al final):
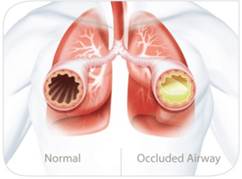
- Humedad sub-óptima: pues una obviedad, el gas no contiene suficiente HA, lo que aumenta el espesor de las secreciones, inicialmente, y va aumentando el riesgo de oclusión del TET por producción de “tapones de moco”.
En intubaciones cortas, podréis comprobar que, al extubar, conforme la nasofaringe empieza a trabajar, el STM se reactiva con la humedad ambiente y el paciente empieza a mover secreciones tosiendo moco muy espeso.
Por otro lado, como la HA depende de la exhalación del paciente, situaciones en las que haya fuga de aire espirado (TET sin neumotaponamiento, fístulas…) o bien el paciente esté limitado para ceder humedad (quemados, deshidratación, hipotermia) hacen que la eficiencia de un HME aquí sea tan limitada que pueda considerarse contraindicada.
- Ventilación sub-óptima: aquí tenemos un par de situaciones mecánicas que merece la pena desarrollar.
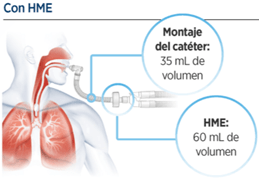
- Espacio Muerto (EM) Instrumental: sabiendo que espacio muerto es la porción de la vía aérea donde no se produce intercambio gaseoso, el EM instrumental es todo aquello que añadimos a partir de la pieza en Y, de la tubuladura de doble rama, hasta la interfaz (TET). A saber: HME, sensor de capnografía, nebulizador, sonda de aspiración cerrada, tubo corrugado, codo… El EM aumentará en base al volumen interno del HME.
A mayor EM, mayor volumen de gas exhalado (rico en CO2, pobre en O2) que el paciente va a reinhalar en inspiración, aumentando la pCO2, y que el médico tendrá que tratar de compensar aumentando el Volumen Corriente (VT). En cuanto a esto, un grupo de investigadores japonés (Chikata et al, Crit Care Res 2012) observó “una tendencia de los HME con menos espacio muerto a proporcionar menos HA”, lo que no ayuda en esto.
Esto es importante porque hace que los HME parezcan incompatibles con la Ventilación Protectora de Pulmón, en tendencia últimamente y de mayor interés en el SDRA (muy visto en Covid19).
- Resistencia al flujo: como decía algo más arriba, el paciente ha de respirar a través del dispositivo mojado, lo que incrementa el esfuerzo mecánico que deberá hacer (más consumo de energía), o nos requerirá aumentar las presiones ventilatorias para compensarlo (estrategia ventilatoria más agresiva) con incremento del riesgo de barotrauma.
Así pues, cualquier situación que incremente el riesgo de fluidos entrando en contacto con el HME (¿por ejemplo el paciente no paralizado tosiendo secreciones espesas a través del TET porque le falta humedad? Bien visto…) elevará la resistencia al paso del flujo (mayor resistencia cuanto más mojado esté), el trabajo respiratorio del paciente y un aumento del riesgo de oclusión del propio HME.
Tened en cuenta, también, que el destete lo seguiréis haciendo con el HME puesto así que, al extubar, el paciente pasará de una presión positiva incrementada, a ventilar fisiológicamente en presión negativa, lo que puede hacer la diferencia más pronunciada para el paciente.
Por otro lado, respecto a aquellos HME que además contienen filtro, es interesante mencionar que los estándares internacionales para testear filtros no exigen que sean eficaces cuando están mojados (9Scott et al, 2010).
Ya puestos a deducir otro poquito, pregunta al aire: ¿cuál es vuestro protocolo para aerosolizar/nebulizar medicamentos con HME? ¿Lo quitáis? ¿Si no lo quitáis, dónde colocáis cada cosa? Recordad que el HME está diseñado para atrapar…
Entendido este concepto de las resistencias ventilatorias, se me ocurre la osadía de aconsejar que no coloquemos HME en los puertos de salida/entrada del respirador. Al margen del debate postCovid sobre si tiene sentido “filtrar” la salida inspiratoria del respi, usemos filtros sin más (no HMEs) para evitar aumentar resistencias.
Tras toda esta matraca, cierro este apartado cumpliendo mi promesa de aportar referencias a las Contraindicaciones al uso de HME de la comunidad científica internacional. Entre ellas la Guía de Práctica Clínica sobre humidificación en ventilación mecánica de la Asociación Americana de Cuidados Respiratorios:
Contraindicaciones absolutas del uso de HME:
- Secreciones espesas, abundantes, sanguinolentas o persistentes10-16
- Fístula broncopleural10,13,16,17
- Fuga importante en la máscara10,18
- Globo de tubo endotraqueal incompetente o ausente10,13,16,19,20
- Volumen corriente espirado (Vt) < 70 % del Vt entregado10
- Recién nacidos y lactantes21
- Hipotermia (temperatura corporal < 32 °C)10,12,14-17
- Medicaciones nebulizadas, como las administradas durante los tratamientos con aerosol10,12,14
- Volumen Minuto elevado (>10 L/min)10,17,14
Contraindicaciones relativas del uso de HME:
- Ventilación no invasiva10,16,18,22
- Volúmenes corrientes bajos, incluida la ventilación protectora de pulmón10,15,16,13
- Síndrome de distrés respiratorio agudo (SDRA)15,17,18,20,25,26
- Tratamiento de la hipercapnia15,12
- Ventilación a largo plazo11,14,17,18
- Quemaduras en la vía aérea15,17,27
- Insuficiencia respiratoria aguda10,18,12,28,29
- Insuficiencia respiratoria crónica30
- Asma27
- Atelectasia17
- Enfermedad pulmonar obstructiva crónica (EPOC)15,17
- Dificultad en el destete de los pacientes16,17,30
- Hemorragia o traumatismo en la vía aérea17,27
- Edema pulmonar12,16
- Paciente immunodeficiente17
Recuerdo un caso en el que se argumentó que el HME “al menos sirve para evitar que las secreciones que tose el paciente lleguen a las tubuladuras, lo que ahorra tener que cambiarlas y solo se sustituye el intercambiador”… Bueno, una vez que entendemos cómo funcionan, cae por su propio peso que con una humidificación óptima no se generaría ese “problema”, de forma que el HME es la causa de esas secreciones, no una solución. Por otro lado, quiero recordar que “romper el circuito” para cambios rutinarios está directamente asociado con Neumonía Asociada a la Ventilación. Luego entraré en eso si os quedan ganas de seguir leyendo.
El caso es que tenemos tan normalizado que las secreciones sean espesas y difíciles de gestionar, que estamos acostumbrados a compensarlo de diversas formas, sin entender que una humidificación óptima evitaría la mayoría de las manipulaciones relacionadas. Nebulizamos salino (a distintas concentraciones), mucolíticos y broncodilatadores, sin embargo, la eficacia clínica de la nebulización no está demostrada en ensayos clínicos, pero sí se relaciona con complicaciones como el broncoespasmo, irritación de la vía aérea y falsos negativos en cultivos de esputo (31Jelic, 2008). Nebulizar agua/salino para aportar humedad cuando la vía aérea superior está bypasseada se ha demostrado que no es tan eficiente como la humidificación adecuada (AARC Clinical Practice Guidelines, 2012).
Incluso instilamos suero fisiológico a través del TET para poder aspirar secreciones (dándole al paciente su ración de vibraciones y percusión) cuando yo discutiría que hay una ausencia de evidencia clínica que soporte esta práctica. De hecho, está asociada con efectos lesivos como oxigenación disminuida (32Halm, 2008) lo que puede llevar a desaturación, e infección (33Hagler, 1994) al arrastrar bacterias del TET hacia las vías aéreas inferiores.
Vale compañero, me dejas sin opciones con esta actitud de refutarlo todo… ¿qué puedo hacer en mi unidad que sea adecuado para mis pacientes ventilados? Bueno, muchos párrafos arriba os comenté que los médicos de cuidados críticos se dividían entre dos alternativas. Os comenté la primera, vamos a por la segunda: la humidificación activa.
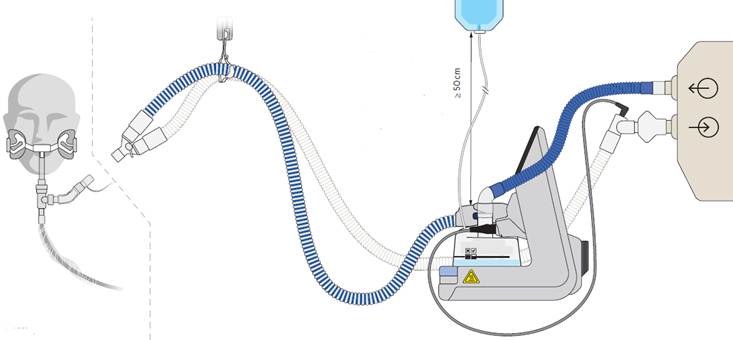
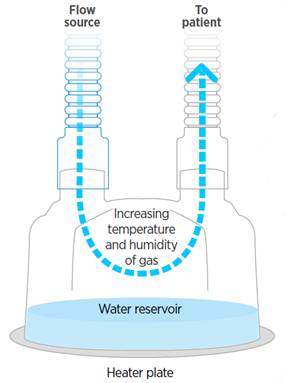
En este caso, la idea es hacer pasar el gas por un dispositivo que contiene una fuente de agua (en constante reciclaje) que se calienta hasta convertirse en vapor, saturando completamente el flujo hasta alcanzar las condiciones BTPS. Este flujo de gas con HR 100% se entrega a través de una rama inspiratoria calentada (requiere corriente eléctrica) y aislada del exterior para evitar el enfriamiento del gas (lo que llevaría a condensación al bajar del “punto de rocío” que comentamos al principio), entregándolo en carina lo más cerca posible a las condiciones de Humedad Óptima que ya hemos comentado. A su vez, el gas exhalado regresa al respirador a través de una rama espiratoria, que también está calentada, y finalmente un filtro diseñado para minimizar la condensación, maximizando la eficiencia de filtrado. Para hacer todo eso de forma precisa, se requieren sondas de temperatura y flujo, a lo largo del circuito, que indiquen al dispositivo cómo modificar las condiciones del gas para que puedan ser las óptimas para el paciente al margen de las situaciones internas y externas.
De esta forma, la fuente de humedad aquí es externa, ahorrándole al paciente el consumo de energía porque el gas ya le llega acondicionado. Cuanto más avanzada sea la tecnología del humidificador, las sondas y tubuladuras, más precisa será la entrega del gas en condiciones óptimas, reduciendo las intervenciones externas. Por otro lado, es interesante resaltar aquí que lo que se entrega con el gas es Vapor de Agua y esto merece ser explicado.
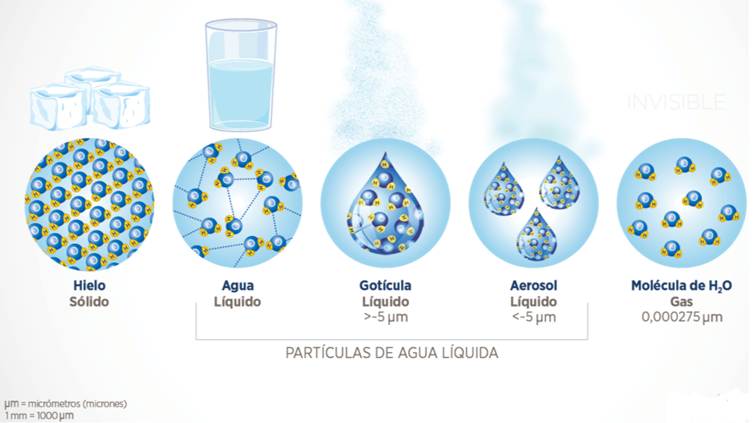
Durante la pandemia, todos fuimos bombardeados con términos como “generador de aerosoles”, “microgotas” y “dispersión de partículas”… pero, ¿realmente sabemos a qué se refieren? Porque la biofísica sigue siendo la misma que antes del Covid19, es solo que nos explotó en la cara y ya no la ignoramos. Venga, repaso exprés:
Teniendo claro los estados del agua (sólido-líquido-gas), tan solo diré aquí que si podéis ver (macroscópico) “el gas” (como en los aerosoles y nebulizaciones) significa que no estáis viendo “gas de agua”, sino agua en estado líquido. Si no lo podéis ver (microscópico) es que estáis en presencia de vapor de agua, es decir, gas real, como ahora el aire que respiras y no ves.
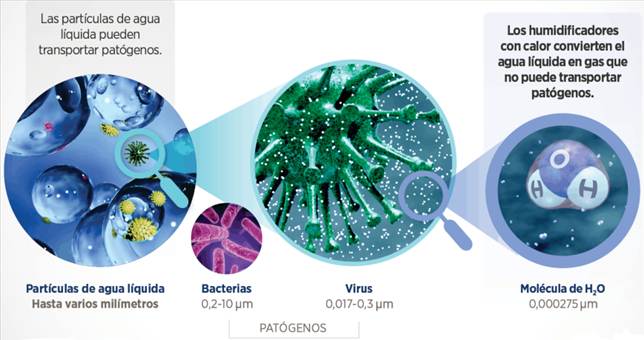
¿Por qué esta aclaración, Jorge? Tengo pacientes que cuidar… Pues porque los patógenos pueden ser transportados por el líquido (dispersión de partículas) ya que son más pequeños que las microgotas y aerosoles, pero no tan pequeños como las moléculas de agua en estado vapor, de ahí que nos protegiésemos en los procedimientos generadores de aerosoles, como intubar, nebulizar… El vapor de agua, sin embargo, no puede, físicamente, desplazar patógenos (34Schulze, 2007) porque las moléculas de agua son 60 veces más pequeñas que el virus más pequeño.
En mi opinión, parece tener sentido que la forma óptima de entregar el gas acondicionado a nuestros pacientes sea a través de humidificadores calentados (Heated Humidifiers, HH) con la tecnología más avanzada posible pero, ¿qué tipo de beneficios terapéuticos ofrecen estos, comparados con los HME, y qué contraindicaciones tiene? Ciñámonos a la evidencia para que se pueda respaldar la práctica clínica. Okey, dale:
- Ayuda a los mecanismos de defensa naturales de las vías respiratorias (35Branson,, 1998) (12Rathgeber, 2006): un sistema de transporte mucociliar cuidado es sinónimo de protección ante los agentes externos y mayor autogestión de las secreciones. Para eso, tratamos de administrar 44mg (de vapor de agua)/L (de gas) a 37°C.
Juega aquí un gran papel la prevención de la Neumonía Asociada a la Ventilación (NAV). Un metaanálisis (36Siempos, 2007) observó que la HH no aumentaba los índices de NAV, comparando con HME. Sin embargo, esos resultados pueden quedarse cortos, ya que los ensayos incluidos no se realizaron con HH de tecnología moderna y doble tubuladura calentada, excepto por uno español (37Lorente et al, 2006) que probó una reducción significativa al usar HH. Más reciente aún, otro estudio español (38Picazo, 2021) confirmaba que la HH, en V. Mecánica, no se correlaciona con el aumento de NAV.
- Facilita el intercambio eficiente de los gases y la ventilación (11Branson, 2007) (10Restrepo et al, 2012): cuanto más fina y fluida sea la capa de moco que el STM ha de desplazar, menor resistencia al flujo ofrece la vía aérea y menos energía gasta el paciente con su trabajo respiratorio.
Alveolos y vías aéreas pequeñas, ocluidos por moco, pueden causar una atelectasia restrictiva, reduciendo la superficie de intercambio gaseoso con la que cuenta el paciente, lo cual afecta a la PaO2 y la PaCO2, que nos lleva a incrementar parámetros ventilatorios en compensación. Enseguida extiendo esto…
Me paro aquí para incidir en la reducción de oclusiones de TET. Os resumo el caso de 39Ginestra et al. (2022) para Covid19: creyendo prevenir contagios, algunos hospitales abandonan la HH y pasan a HME, experimentando inmediatamente complicaciones; cuando analizaron y regresaron a la HH, las tasas de obstrucción y de reintubación descendieron drásticamente. Otro estudio (40Al Dorzi et al, 2022) comparó las oclusiones de TET antes y después de la implementación de un protocolo de humidificación basado en la evidencia en seis UCI. La mayoría de oclusiones se produjeron antes de implementarlo (solo con HME) y, después de la implementación, el 90% de las oclusiones que aún sucedieron fueron con HME.
- Permite el uso de estrategias de ventilación protectora de los pulmones (LPV) (10Restrepo et al, 2012) y puede facilitar el destete: las LPV tienen como objetivo presiones y volúmenes lo más cercanas a lo fisiológico, con idea de reducir la lesión asociada a la ventilación mecánica. Objetivo clave: el paciente con Síndrome de Distrés Respiratorio Agudo (SDRA), del que hemos oído mucho en pandemia.
Ya hemos hablado de cómo aumentar el espacio muerto (EM) influye en aumento de la PaCO2 a no ser que se incremente la MV (Minute Volume), lo cual torpedearía la estrategia. Además, recordad que el destete será más sencillo cuanto más fisiológicos sean los parámetros. Veamos por qué la HH ayuda al esfuerzo inspiratorio y la retirada.
La Humidificación Activa no añade EM, es más, 41Shimoda et al. (2021) demostraron que, si quitaban el HME y el tubo corrugado post pieza en Y, sustituyéndolos por HH en sus pacientes con SDRA, se reducía la PaCO2 sin aumentar parámetros del respirador.
30Girault et al. (2003) concluyeron que para compensar el paso de HH a HME habría que incrementar la Presión de Soporte en 8 cmH2O. Más tarde, 20Morán et al. (2006) identificaron que cambiar de HME a HH limita la indeseada hipercapnia y que, si ésta no es un problema, nos permite reducir un potencialmente dañino Vt (ver imagen de la izquierda). Pero, si buscamos algo más nuevo, 42Pitoni et al. (2021), en ventilación protectora para lesión cerebral aguda y SDRA, también se pasaron a la HH para mejorar parámetros ventilatorios sin afectar a la perfusión cerebral.
- Puede aumentar la comodidad del paciente y su tolerancia a la Ventilación No Invasiva (VNI) (43Hernández et al, 2022) (44Esquinas et al, 2012): al entregar gas a través de una interfaz de VNI, el paciente usa su nasofaringe pero, teniendo una frecuencia respiratoria más elevada de lo habitual, si se le expone a gas seco (recordad que los HME están contraindicados) a flujos altos y presiones elevadas, el STM puede resultar perjudicado y hacer la terapia más incómoda.
Por esa razón, al usar HH en VNI se reduce la temperatura a niveles de nasofaringe (31°C), o incluso algo más bajos si ello favorece la comodidad y adhesión a la terapia (43Hernández et al, 2022), es decir, hay que quitar menos veces la máscara. La clave aquí es asegurarse de que el dispositivo de HH siempre entregue el 100% de HR (completamente saturado de vapor) para la temperatura seleccionada.
Otro factor relacionado con la Humidificación Activa es la elección de la interfaz de VNI: cuanto más grande sea la interfaz, más piel queda expuesta al gas humidificado. Como la piel es más fría que la mucosa de la vía aérea superior, se producirá condensación en la interfaz, incluso empañando en el caso de las faciales (full face). Interfaces más pequeñas (oronasales de apoyo en puente o bajo nariz), por el contrario, ofrecen menos espacio muerto y son muy compatibles con la HH (45Luján, 2021).
Hasta aquí he mencionado los beneficios terapéuticos, pero me ha faltado decir que, a día de hoy, no ha habido contraindicaciones al uso de Humidificación Activa en ventilación (mecánica o no). También me parece de interés común el retratar aquí que, aunque no hay un consenso español en ventilación invasiva, sí existe en Guías de Práctica Clínica americana y francesa, como muestro a continuación:
10Respir. Care 2012;5(5):782–788 26Papazian and Ann, Intensive Core. (2019) 9:69
Respecto a Guías de Práctica Clínica que relacionen la humidificación con la Ventilación Mecánica No Invasiva, aquí la cosa se pone más interesante, ya que hay muchas sociedades científicas que opinan similar:
Y, aquí sí, a nivel nacional, los especialistas en ventilación de distintas sociedades (SEPAR, SEMICYUC, SEMES, SEDAR…) acordaron en 2021 alinearse con la humidificación activa como veréis en la siguiente captura de dos páginas del documento original45:

Finalmente, también es adecuado mencionar aquí que una terapia muy común (aunque relativamente nueva) en nuestro día a día, como es el Alto Flujo a través de Cánula Nasal, no sería posible sin la humidificación activa. Caudales de gas tan elevados, a través de la nariz, podrían causar molestias y hacer que los pacientes abandonasen el tratamiento. De hecho, la correcta humidificación del flujo es uno de los mecanismos de acción más importantes de la terapia.
Si los fabricantes de “gafas nasales” (bajo flujo u oxigenoterapia convencional) limitan su uso a los 2-4L/min por esta razón, pensad cómo afecta al STM cuando les aplicamos 15L/min (sin HH) a través de una máscara tipo Venturi o un reservorio…
Para concluir ¡yey! sobre la base de mi experiencia y entendimiento: la incidencia de la Neumonía Asociada a la Ventilación (NAV) en paciente intubado, a grandes rasgos, puede reducirse en gran medida con el equipo adecuado.
Un tubo en la garganta es una autopista, en forma de tobogán, para que entren patógenos a donde no deberían, más si los empujamos con chorros de salino o con una sonda de aspiración. Una de las grandes causas de la NAV es la llegada de secreciones de nasofaringe (o incluso digestivas) a las vías aéreas inferiores. De ahí que hemos pasado a usar TET con globo de presión traqueal y aspiración subglótica (46Zolfaghari, 2011).
El motivo principal para la aspiración subglótica es que las secreciones del propio paciente pueden pasar entre las paredes de la tráquea y el globo, principalmente cada vez que desconectamos una parte del circuito respiratorio para cualquier técnica o cambio de parte del mismo (47Pitts et al, 2010). Lo que sucede entonces es que la PEEP que estamos administrando a los pulmones (sellados por el globo) y que está manteniendo esas secreciones encima del globo, se neutraliza (desreclutando alveolos y exponiéndolos potencialmente a microgotas) igualando a la presión atmosférica, lo que genera unos canales/pliegues en el globo por los que resbalan las secreciones. De ahí que en las directrices 2021 de Neumonia Zero (NZ) las recomendaciones sean el uso de aspiración continua subglótica y el control continuo de la presión del globo.
Ah, y por si lo estás pensando, hinchar más el globo podría tener efectos nocivos en las paredes de la tráquea. ¿Qué relación guarda esto con la humidificación? Sencillo, todos los cambios rutinarios de HME, más las técnicas de compensación (salino, nebulizaciones) para paliar las limitaciones de éstos, y las aspiraciones de secreciones que estas técnicas generan, pueden hacer que “rompamos el circuito” más veces de las necesarias. La humidificación activa, con la tecnología y la formación adecuadas, puede reducir todas esas interacciones con el circuito al mínimo.
Últimos consejos que me permito darte: recuerda preguntar siempre ¿por qué? y rebelarte ante la respuesta del “porque siempre lo hemos hecho así”, y nunca dejes de cuidarte si quieres seguir cuidando a otros.
Podéis descargar el artículo completo AQUI:
Jorge Torondel
Marzo’25, Valencia
He escrito este artículo para profesionales sanitarios. Como siempre, mis palabras no son un sustituto de vuestro propio juicio clínico como profesionales sanitarios cualificados. Si quieres buscarme y ver qué otras cosas hago, puedes encontrar mi perfil en este enlace de LinkedIn
Referencias:
- Dawson, J. A., Owen, L. S., Middleburgh, R. & Davis, P. G. Quantifying temperature and relative humidity of medical gases used for newborn resuscitation. J. Paediatr. Child Health 50, 24–26 (2014).
- Williams, R. B., Rankin, N., Smith, T., Galler, D. & Seakins, P. Relationship between the humidity and temperature of inspired gas and the function of airway mucosa. Crit. Care Med. 24, 1920–1929 (1996).
- Ryan, S. N., Rankin, N., Meyer, E. & Williams, R. Energy balance in the intubated human airway is an indicator of optimal gas conditioning. Crit. Care Med. 30, 355–361 (2002).
- Darin J, Broadwell J, MacDonell R. An evaluation of water-vapor output from four brands of unheated, prefilled bubble humidifiers. Respir Care. 1982 Jan;27(1):41-50.
- Franchini, M. L. et al. Oxygen With Cold Bubble Humidification Is No Better Than Dry Oxygen in Preventing Mucus Dehydration, Decreased Mucociliary Clearance, and Decline in Pulmonary Function. Chest 150, 407–414 (2016).
- Rhame FS, Streifel A, McComb C, Boyle M. Bubbling humidifiers produce microaerosols which can carry bacteria. Infect Control. 1986 Aug;7(8):403-7.
- Lellouche, F. et al. Humidification performance of 48 passive airway humidifiers: comparison with manufacturer data. Chest 135, 276–286 (2009).
- Scott DH, Fraser S, Willson P, Drummond GB, Baillie JK. Passage of pathogenic microorganisms through breathing system filters used in anaesthesia and intensive care. Anaesthesia. 2010 Jul;65(7):670-3.
- Halm MA, Krisko-Hagel K. Instilling normal saline with suctioning: beneficial technique or potentially harmful sacred cow? Am J Crit Care. 2008 Sep;17(5):469-72.
- Restrepo, R. D. & Walsh, B. K. AARC Clinical Practice Guideline. Humidification during invasive and noninvasive mechanical ventilation: 2012. Respir. Care 57, 782–788 (2012).
- Branson, R. D. Secretion management in the mechanically ventilated patient. Respir. Care 52, 1327–1328 (2007)
- Rathgeber, J. Devices Used to Humidify Respired Gases. Respir. Care Clin. N. Am. 12, 165– 182 (2006).
- Branson RD. Preventing Moisture Loss from Intubated Patients. Clin Pulm Med. 2000;7(4):187-98.
- Branson RD, Davis Jr K, Brown R, Rashkin M. Comparison of three humidification techniques during mechanical ventilation: patient selection, cost, and infection considerations. Respir Care. 1996;41(9):809-816.
- Plotnikow GA, Accoce M, Navarro E, Tiribelli N. Humidification and heating of inhaled gas in patients with artificial airway. A narrative review. Rev Bras Ter intensiva. 2018 Mar;30(1):86-97.
- Branson RD. The ventilator circuit and ventilator-associated pneumonia. Respir Care. 2005 Jun;50(6):774-7.
- Ricard J-D, Cook D, Griffith L, Brochard L, Dreyfuss D. Physicians’ attitude to use heat and moisture exchangers or heated humidifiers: a Franco-Canadian survey. Intensive Care Med. 2002 Jun;28(6):719-25.
- Branson RD. Humidification of respired gases during mechanical ventilation: mechanical considerations. Respir Care Clin N Am. 2006 Jun;12(2):253-61.
- Campbell RS, Davis K.J, Johannigman JA, Branson RD. The effects of passive humidifier dead space on respiratory variables in paralyzed and spontaneously breathing patients. Respir Care. 2000 Mar;45(3):306-12.
- Morán, I., Bellapart, J., Vari, A. & Mancebo, J. Heat and moisture exchangers and heated humidifiers in acute lung injury/acute respiratory distress syndrome patients. Effects on respiratory mechanics and gas exchange. Intensive Care Med. 32, 524–531 (2006).
- Doctor TN, Foster JP, Stewart A, Tan K, Todd DA, McGrory L. Heated and humidified inspired gas through heated humidifiers in comparison to non-heated and non-humidified gas in hospitalised neonates receiving respiratory support. Cochrane Database Syst Rev. 2017 Feb 24;20l7(2):CD012549.
- Lellouche F, Maggiore SM, Deye N, Tallié S, Pigeot J, Harf A, et al. Effect of the humidification device on the work of breathing during noninvasive ventilation. Intensive Care Med. 2002 Nov;28(11):1582-9.
- Hinkson CR, Benson MS, Stephens LM, Deem S. The effects of apparatus dead space on P(aCO2) in patients receiving lung-protective ventilation. Respir Care. 2006 Oct;51(10):1140-4.
- Cerpa F, Cáceres D, Romero-Dapueto C, Giugliano-Jaramillo C, Pérez R, Budini H, et al. Humidification on Ventilated Patients: Heated Humidifications or Heat and Moisture Exchangers? Open Respir Med J. 2015 Jun 26;9:104-11.
- Prat G, Renault A, Tonnelier J-M, Goetghebeur D, Oger E, Boles J-M, et al. Influence of the humidification device during acute respiratory distress syndrome. Intensive Care Med. 2003 Dec;29(12):2211-5.
- Papazian L, Aubron C, Brochard L, Chiche J-D, Combes A, Dreyfuss D, et al. Formal guidelines: management of acute respiratory distress syndrome. Ann lntensive Care. 2019 Jun;9(1):69.
- Boots RJ, George N, Faoagali JL, Druery J, Dean K, Heller RF. Double-heater-wire circuits and heat-and-moisture exchangers and the risk of ventilator-associated pneumonia. Crit Care Med. 2006 Mar;34(3):687-93.
- Pelosi P, Solca M, Ravagnan I, Tubiolo D, Ferrario L, Gattinoni L. Effects of heat and moisture exchangers on minute ventilation, ventilatory drive, and work of breathing wring pressure-support ventilation in acute respiratory failure. Crit Care Med. 1996 Jul;24(7):1184-8.
- Jaber S, Chanques G, Matecki S, Ramonatxo M, Souche B, Perrigault P-F, et al. Comparison of the effects of heat and moisture exchangers and heated humidifiers on ventilation and gas exchange during non-invasive ventilation. Intensive Care Med. 2002 Nov;28(11):1590-4.
- Girault, C. et al. Mechanical effects of airway humidification devices in difficult to wean patients*. Crit. Care Med. 31, 1306–1311 (2003).
- Jelic, S., Cunningham, J.A. & Factor, P. Clinical review: Airway hygiene in the intensive care unit. Crit Care 12, 209 (2008).
- Halm MA, Krisko-Hagel K. Instilling normal saline with suctioning: beneficial technique or potentially harmful sacred cow? Am J Crit Care. 2008 Sep;17(5):469-72.
- Hagler DA, Traver GA. Endotracheal saline and suction catheters: sources of lower airway contamination. Am J Crit Care. 1994 Nov;3(6):444-7
- Schulze, A. Respiratory gas conditioning and humidification. Clin. Perinatol. 34, 19–33 (2007).
- Branson, RD. The effects of inadequate humidity.. Respiratory care clinics of North America. 1998;4(2):199-214.
- Siempos, I. I., Vardakas, K. Z., Kopterides, P. & Falagas, M. E. Impact of passive humidification on clinical outcomes of mechanically ventilated patients: a meta-analysis of randomized controlled trials. Crit. Care Med. 35, 2843–2851 (2007).
- Lorente L, Lecuona M, Jiménez A, Mora ML, Sierra A. Ventilator-associated pneumonia using a heated humidifier or a heat and moisture exchanger: a randomized controlled trial [ISRCTN88724583]. Crit Care. 2006;10(4)
- Picazo L, Gracia Arnillas MP, Muñoz-Bermúdez R, Durán X, Álvarez Lerma F, Masclans JR. Active humidification in mechanical ventilation is not associated to an increase in respiratory infectious complications in a quasi-experimental pre-post intervention study. Med Intensiva (Engl Ed). 2021 Aug-Sep;45(6):354-361.
- Ginestra JC, Mitchell OJL, Anesi GL, Christie JD. COVID-19 Critical Illness: A Data-Driven Review. Annu Rev Med. 2022 Jan 27;73:95-111
- Al Dorzi, H. M. et al. Humidification during mechanical ventilation to prevent endotracheal tube occlusion in critically ill patients: A case control study. Ann. Thorac. Med. 17, 37–43 (2022)
- Shimoda, T. et al. Removal of a catheter mount and heat-and-moisture exchanger improves hypercapnia in patients with acute respiratory distress syndrome: A retrospective observational study. Medicine (Baltimore). 100, e27199 (2021).
- Pitoni S, D’Arrigo S, Grieco DL, Idone FA, Santantonio MT, Di Giannatale P, Ferrieri A, Natalini D, Eleuteri D, Jonson B, Antonelli M, Maggiore SM. Tidal Volume Lowering by Instrumental Dead Space Reduction in Brain-Injured ARDS Patients: Effects on Respiratory Mechanics, Gas Exchange, and Cerebral Hemodynamics. Neurocrit Care. 2021 Feb;34(1):21-30.
- Hernández G, Paredes I, Moran F, Buj M, Colinas L, Rodríguez ML, Velasco A, Rodríguez P, Pérez-Pedrero MJ, Suarez-Sipmann F, Canabal A, Cuena R, Blanch L, Roca O. Effect of postextubation noninvasive ventilation with active humidification vs high-flow nasal cannula on reintubation in patients at very high risk for extubation failure: a randomized trial. Intensive Care Med. 2022 Dec;48(12):1751-1759. doi: 10.1007/s00134-022-06919-3. Epub 2022 Nov 18. Erratum in: Intensive Care Med. 2023 Mar;49(3):385.
- Esquinas Rodriguez, A. M. et al. Clinical review: humidifiers during non-invasive ventilation–key topics and practical implications. Crit. Care 16, 203 (2012).
- Luján M, Peñuelas Ó, Cinesi Gómez C, García-Salido A, Moreno Hernando J, Romero Berrocal A, Gutiérrez Ibarluzea I, Masa Jiménez JF, Mas A, Carratalá Perales JM, Gaboli M, Concheiro Guisán A, García Fernández J, Escámez J, Parrilla Parrilla J, Farrero Muñoz E, González M, Heili-Frades SB, Sánchez Quiroga MÁ, Rialp Cervera G, Hernández G, Sánchez Torres A, Uña R, Ortolà CF, Ferrer Monreal M, Egea Santaolalla C. Summary of recommendations and key points of the consensus of Spanish scientific societies (SEPAR, SEMICYUC, SEMES; SECIP, SENEO, SEDAR, SENP) on the use of non-invasive ventilation and high-flow oxygen therapy with nasal cannulas in adult, pediatric, and neonatal patients with severe acute respiratory failure. Med Intensiva (Engl Ed). 2021 Jun-Jul;45(5):298-312.
- Zolfaghari PS, Wyncoll DL. The tracheal tube: gateway to ventilator-associated pneumonia. Crit Care. 2011;15(5):310.
- Pitts R, Fisher D, Sulemanji D, Kratohvil J, Jiang Y, Kacmarek R. Variables affecting leakage past endotracheal tube cuffs: a bench study. Intensive Care Med. 2010 Dec;36(12):2066-73.
………………………………….
DECLARACION DE CONFLICTO DE INTERESES: el autor del blog no recibe ni ha recibido ninguna contraprestación de ningún tipo por esta publicación, fruto de la amistad de años con su autor.







Hola buenos dias. Estimado Colega, le escribo para solicitarle una ayuda por tus conocimientos en la UCI. Resulta que estamos enfrentando una alta morbilidad de maternas graves con LRA, que necesitan de la Terapia Reemplazo Renal (TRR) que evolucionan con mala hemodinámica durante la HD. En Realidad si tienes algo publicado en Tu Blog y que pudiéramos consultar. Saludos cordiales
Dr. José Luis Rodríguez López
Esp. Nefrología
ORCID: htpps://orcid.org/0000-0002-6276-4589
Web Nefrologia
http://joseluisrodriguez086.blogspot.com
Hola Jose Luis! Pues desgraciadamente no tengo conocimientos al respecto, ni algo tan especifico publicado en el blog.
Te dejo enlace al Grupo de Trabajo de TDREE de la SEEIUC donde está mi buen amigo Pablo Sánchez por si te pueden orientar con más certeza, ya que han publicado un manual recientemente que tal vez lo recoja.
https://seeiuc.org/gt-terapias-continuas-depuracion-extrarenal/
Abrazo grande!
isidro
excelente post. Podría regalarme su email para pedir de su apoyo con material y artículos por favor. Gracias y saludos
Gracias por esta información, saludos desde Oaxaca México
Muchisismas gracias por comentar! saludos!